|
但高端疫苗抗原对外声称是美国国立卫生研究院(NIH)所设计并授权,就遭到了一位不具名并实际参与研发的大陆在美科学家的不满。他在社交媒体上表明:“事实上NIH只占有不到一半的知识产权。我和我老板自然也不是为美国政府卖命的。”这个意外的花絮为民进党政府所谓的处处排斥大陆的行为增添了一丝尴尬。这个所谓的美国政府专利技术的核心,来自大陆的这位科学家是事实上的主要设计者,论文2017年在PNAS发表时,这位大陆在美的科学家为共同第一作者。NIH贡献其实不大,并没有通讯作者。严格意义上是三家一起申的专利。 莫德纳和辉瑞的疫苗毫无疑问使用了这一技术,在对莫德纳疫苗研究的论文中很早就提到过703 专利申请。实际上,根据美国专业媒体报道,2020年1月10 日,中国科学家将新冠病毒的基因序列上传到开放访问网站GenBank上,此前几天,格拉汉姆的实验室和莫德纳刚刚合作设计了一种针对用于导致冠状病毒传染病病毒的实验疫苗。正如宾夕法尼亚大学 mRNA 疫苗科学家Norbert Pardi 所说,我们“实际上非常幸运”,科学家们在本次疫情前为MERS疫苗制定了2P突变,“否则,莫德纳疫苗不可能发展得这么快”。中国公布病毒基因图谱几天之后,格拉汉姆的团队就将疫苗的基因设计图通过电子邮件发送给了莫德纳开始生产,到2020年2月下旬,莫德纳已经为临床试验生产了足够的疫苗。 现在西方制药公司研发的新冠疫苗都用到了2016 年的这一发明,其中,只有研发辉瑞疫苗的德国生物技术公司向美国政府支付了该技术的专利许可费用。根据 2020 年 12 月 NIAID 的通告,全球大约20家公司拥有这项发明的使用许可,包括Medigen;Noachis Terra;OncoSe;BioNTech AG(德国生物技术公司);N4 Pharm UK Limited;Dynavax;RNAceutical;赛诺菲巴斯德;葛兰素史克生物制品公司等。Medigen就是台湾的高端疫苗生物制剂有限公司。这里的另外一家美国疫苗制造企业Dynavax,也是台湾高端疫苗的重要合作伙伴,疫苗佐剂之一是该公司提供的CpG 1018,这一佐剂前几年被美国批准用于乙肝重组疫苗。 所谓疫苗佐剂,其作用就是通过调节或增强机体对抗原的免疫应答来提高疫苗的效力,同时可减少抗原用量,提高疫苗的安全性。随着对佐剂的研究,人们发现两种或两种以上佐剂联合应用时可通过激活多种免疫机制发挥协同作用。对于一些难以清除的病原体和免疫系统功能低下的人群来说,更为迫切需要高效力的疫苗,而这可通过佐剂的联合应用予以解决。高端疫苗的佐剂其实就是CpG 的DNA序列+氢氧化铝。两者组合据称可以有效提高中和抗体水平,并将单用氢氧化铝佐剂诱导的Th1偏倚改成了Th2偏倚,减少疫苗的潜在风险。 
| 蔡英文先后两次在高端疫苗股票下跌之际参访打气,被外界质疑有炒股嫌疑。 
I期45人次,II期3752人,试验称高剂量组几乎达到了莫德纳或诺瓦瓦克斯的水平,为何被指数值无意义?台湾68.6%的民众为何不敢接种? 应该说,从纸面上看,高端疫苗并不是台式作坊的产物,但问题在于实效。很多时候,作用原理是一样的,生产原料甚至生产流程都是一样的,却未必能生产出同样有效的疫苗。从S-2P专利使用许可清单上也可以看出,那么多厂商都有这个技术,但似乎并没有几家现在生产出来了疫苗。而外界对高端疫苗的质疑也在于此。其实说是外界,也就是台湾人自己,它那么小的一个市场,全世界没有哪家大公司很在意其自研疫苗。 事实上,自高端疫苗去年5月宣布与美国国卫院签约合作开发疫苗,台湾当局就认为“押到了一个大宝”。蔡英文曾对此表示期待“早日开花结果”,以证明台湾团队在疫苗的开发与生产上,拥有进军全球疫苗市场的实力。 台湾前副领导人,“中研院”院士陈建仁夫妇也接受高端疫苗第二期老年组的人体实验,据传陈建仁是和高端实验计划召集总主持人林奏延熟识,因此决定力挺高端疫苗。而高端疫苗内部也配置了几乎台湾本土最强的科研人力,其人体临床试验执行医院是长庚医院,召集人是小儿感染科教授林奏延。林奏延曾于江宜桦内阁担任“卫福部”代理部长、林全内阁担任“卫福部”部长。美国NIH的授权专利、与辉瑞、莫德纳使用相同的技术,超强的人力配置,显然成为了高端疫苗被当局看好的一个“重大法宝”。 但所有的疫苗临床试验都表明,并不是所有的前期试验效果好,就最终会得到一个好的效果。除了股市会被炒高例外。 
根据当前看到的数据,在I期临床实验中,高端疫苗号称诱导出了非常强的中和抗体水平。低中高三个剂量组志愿者血清对原始毒株的中和效力(NT50滴度)分别是33、76和167,而康复者血清是43,看起来高中两个组的中和效力是康复者血清的3.88倍和1.77倍,高剂量组几乎达到了莫德纳或诺瓦瓦克斯的水平。但是,站在产品角度看,I期临床实验的这个数值不能说没有意义,至少意义有限,因为疫苗评价是从群体角度判断能否实现一定的保护率,从传染病防控角度证明疫苗能够有效阻断病毒的传播,而不是针对每一个个体判断疫苗是否有效。 
高端疫苗的二期临床试验于6月10日揭盲。根据其公布的数据,二期临床试验今年1月22日开始第一名受试者接种疫苗,4月28日完成所有受试者第二针接种,接种人数共3752位,年龄最大的89岁。结果显示安全性与耐受性良好,所有受试者未出现严重不良反应,只是注射部位有疼痛感;在免疫生成性部分,不区分年龄组的情况下,疫苗组在接种第二针后28天的血清阳转率达99.8%;20—64岁疫苗组的这一数字为99.9%。 台湾“食药署”副组长吴明美称,高端疫苗公布的临床数据,尚看不出好坏,必须等到6月下旬英国阿斯利康疫苗的抗体效价出来后,才能比较出到底做得好不好。当天,“食药署”公布了一套被媒体称为高端疫苗量身定做的法规:“自产疫苗紧急授权审查标准”,包括应检附数据要求、安全性评估标准和疗效评估标准3项,其中最重要的是疗效评估。 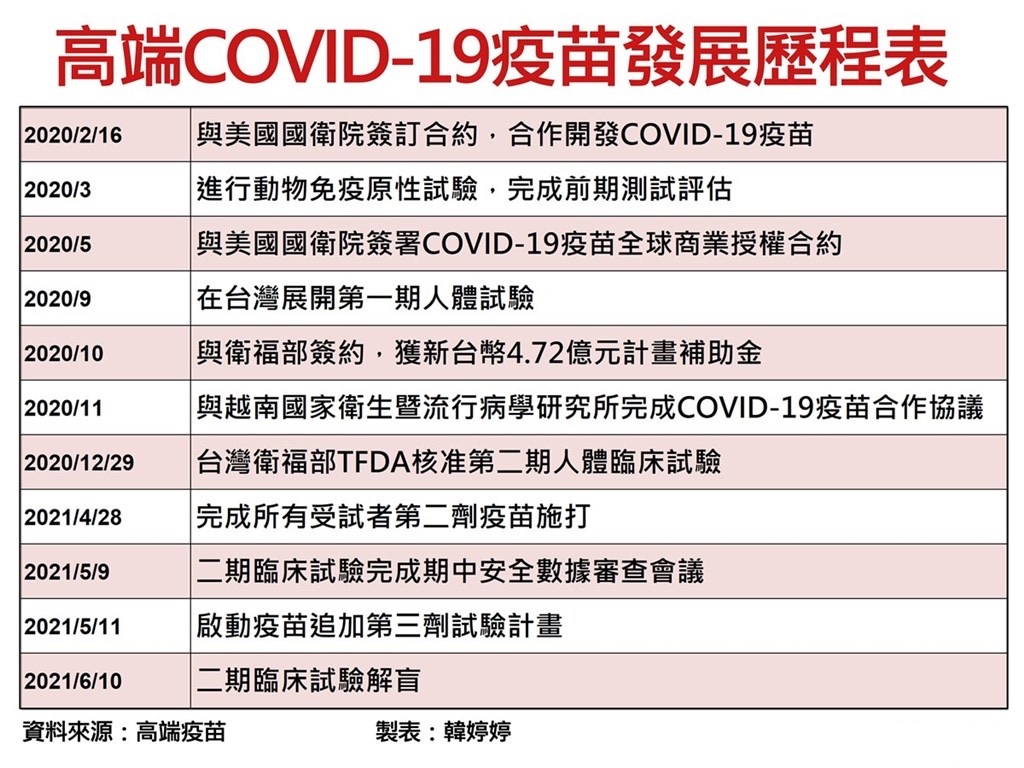
对于这个早就可以“预设到的结论”,台媒采访的多位专家多认为高端疫苗临床实验的样本数太少了,I期才进行了45人次,II期4000人,这都与其它疫苗上市前要做III期临床实验,且要数万人次样本,相距甚远。而疫苗保护力的研究结论只能来自疫苗上市前及上市后大规模的临床研究数据,因此在没有充分数据支持、且新冠疫苗免疫机理研究及中和抗体中和机制研究尚不透彻的情况下,针对疫苗接种个体进行中和抗体检测,既不能给疫苗评价提供有效支持,也不能给接种者个体提供有效的信息,不具备显著的必要性。同样道理,把已经上市的疫苗的中和效力数据单独拿出来比较高低,也不是一种科学的鉴定疫苗有效性的方法。 当前,台湾地区主要争论的一个问题是,鉴于美国FDA已经宣布除了诺瓦瓦克斯的疫苗,不再对其它处于III期临床试验前阶段的在研疫苗给予紧急授权使用资格, 台当局是不是还给高端疫苗此类授权,或者乖乖去做III期临床实验。根据台所谓食品药物管理署规定,高端疫苗若要通过紧急使用授权,其中和抗体水平需高过英国阿斯利康疫苗,于是台方采样200名接种过两剂阿斯利康疫苗的志愿者血清并送检,预计月底会有结果。且不说这个比对方式是否科学,其样本量依旧是一言难尽。 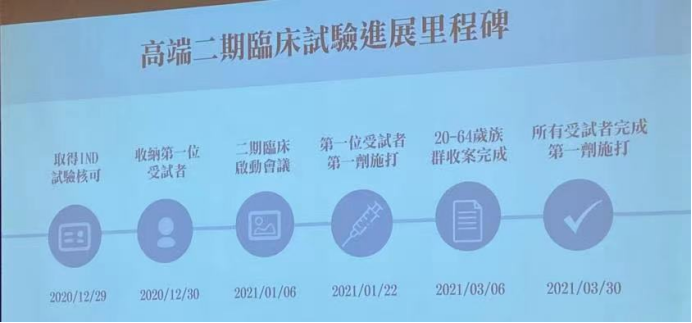
同时,根据台湾媒体6月15日报道,其所谓友邦的巴拉圭亚松森大学医学院4月22日和高端疫苗生物制剂有限公司举行视讯会议,讨论合作研发新冠疫苗及在巴拉圭临床实验的事宜,双方表达高度合作意愿,后续在5月12日签署合作备忘录,拟在当地展开III期临床实验。更有意思的是,III期实验还没开始,更没有国际和他国的使用授权,台当局6月14日已经急着宣布,一旦高端疫苗获得紧急使用授权,在满足台岛需求的同时,同样乐愿分享给“友邦”协助对抗疫情。
对于高端疫苗来说,前面似并无坦途。日前已有媒体质疑高端疫苗母公司基亚生技的历史不太“清白”:基亚生技在2014年研制肝癌药物,并且声称技术授权源来自于澳大利亚药厂普基(Porgen),该项消息让公司股价一时暴涨,但是在完成临床三期实验后,解盲数据未见成效,随后迎来的是连续20日的跌停,甚至出现追高散户承受不住自杀的案例,而该事件也属台湾生技史上的“核弹级事件”。基亚生技麾下子公司基亚疫苗于2017年更名为高端疫苗,并且在2020年2月挂牌上市。 蔡英文虽极力力挺这家公司,更扬言称自己将等待接种高端疫苗。但不久后就传出其已接种辉瑞疫苗的消息,尽管当局极力辨称为谣言,但却拿不出实质的证明。 事实上,台湾人自己都不太敢用这款名为高端的疫苗。yahoo奇摩网站6月11日以“高端疫苗二期解盲成功,你会想打吗?为题,发起网络民调。截至17日为止,已有超过10万人参与投票,其中有52.2%的网友表示“一定不会”、倾向不施打的人数占68.6%;此外,在“你对高端疫苗通过国际认证有没有信心?”一题中,49.6%的台湾网友表示“完全没信心”、21.5%表示“不太有信心”。
|